- 1Institut de Physiologie Musicale et de Médecine des Musiciens, Université de Musique, de Théâtre et des Médias de Hanovre, Hanovre, Allemagne
- 2Institut de Recherche en Neurorééducation (InFo), Clinique BDH Hessisch Oldendorf, Institut Associé de l'École de Médecine de Hanovre (MHH), Hessisch Oldendorf, Allemagne
- 3Département de Neurologie & AVC, Institut Hertie pour la Recherche Clinique sur le Cerveau, Université Eberhard Karls de Tübingen, Tübingen, Allemagne
- 4Département de Psychiatrie et de Psychothérapie, Centre Médical Universitaire de Mayence, Mayence, Allemagne
- 5SRH Hochschule der Populären Künste (HDPK), Berlin, Allemagne
La thérapie musicale neurologique dans la rééducation des patients victimes d'AVC s'est révélée être un complément prometteur aux stratégies de rééducation conventionnelles souvent ardues. L'objectif de cette étude était triple : (i) reproduire les résultats d'une étude précédente avec un échantillon provenant d'une seule clinique (désormais appelée Site 1 ; N = 12) en utilisant un système d'enregistrement déjà établi, (ii) reproduire conceptuellement les résultats précédents avec un système de suivi manuel moins coûteux au Site 2 (N = 30), et (iii) comparer les résultats des deux sous-études pour estimer l'efficacité de la thérapie musicale neurologique. Les patients victimes d'AVC dans les deux sites ont été assignés de manière aléatoire à des groupes de traitement ou de contrôle et ont reçu un entraînement quotidien de mouvements guidés séquentiels du membre supérieur en plus de leur protocole de rééducation standard de l'AVC. Les groupes de traitement recevaient une sonification (c'est-à-dire des changements de hauteur musicale) de leurs mouvements lorsqu'ils bougeaient leur main affectée vers le haut et vers le bas pour reproduire une séquence des six premières notes d'une gamme de do majeur. Les groupes témoins ont reçu le même protocole de mouvement, mais sans rétroaction auditive. Des capteurs au niveau du bras supérieur et de l'avant-bras (Xsens) ou un dispositif de capteur optique (Leapmotion) ont permis de mesurer la cinématique des mouvements et la fluidité des mouvements. Les mesures comportementales avant et après l'intervention comprenaient l'évaluation de Fugl-Meyer (FMA) et l'échelle d'impact de l'AVC (SIS) ainsi que les données de mouvement. La régression bayésienne n'a pas montré de preuves soutenant un effet supplémentaire de la sonification sur les évaluations cliniques de la mobilité. Cependant, les données de mouvement combinées des deux sites ont montré de légères améliorations de la fluidité des mouvements pour le groupe de traitement, et un avantage pour l'un des deux systèmes de capture de mouvement. Les analyses exploratoires de la cohérence de phase EEG-EMG lors du mouvement du bras parétique dans un sous-ensemble de patients ont suggéré des augmentations de la cohérence de phase cortico-musculaire spécifiquement dans l'hémisphère ipsilésionnel après la thérapie de sonification, mais pas après la thérapie de rééducation standard. Nos résultats montrent que la sonification musicale est un complément de traitement viable aux méthodes actuelles de neuroréhabilitation, avec des avantages cliniques limités. Cependant, étant donné l'enthousiasme des patients pendant l'entraînement et le faible coût matériel de l'un des systèmes, il peut être envisagé comme une thérapie de neuroréhabilitation à domicile supplémentaire.
Introduction
Les survivants d'un AVC souffrent fréquemment de handicaps sévères. Un AVC peut entraîner des déficiences dans les systèmes moteur et sensoriel, la régulation des émotions, la perception du langage et les fonctions cognitives (Morris et Taub, 2008). Les dysfonctionnements du bras causés par un handicap moteur important sont également une conséquence courante de l'AVC, affectant énormément la qualité de vie d'un nombre considérable de patients. Dans ce cas, regagner le contrôle sur les mouvements du corps est l'un des composants cruciaux de la récupération post-AVC. Il y a un besoin urgent de méthodes efficaces de rééducation motrice pour améliorer la qualité de vie des survivants d'AVC. Différentes approches thérapeutiques telles que la Thérapie du Mouvement Induit par Contrainte (CIMT), la pratique mentale, la thérapie assistée par robot, la biofeedback électromyographique et l'entraînement de tâches répétitives ont été appliquées pour améliorer la fonction du bras après un AVC (Langhorne et al., 2009). À noter qu'une revue récente a suggéré que la thérapie musicale neurologique pourrait être plus efficace que la physiothérapie conventionnelle (pour une revue récente voir Sihvonen et al., 2017).
Motivational factors seem to play an important role for the beneficial effects of neurologic music therapy. From the patients’ informal descriptions of their experience with music-supported training, it appears that this is frequently highly enjoyable and a highlight of their rehabilitation process, regardless of the form of auditory stimulation, be it piano tones, or sonification of movement with other timbres [for a review see Altenmüller and Stewart (2018)]. However, effects of music supported therapy in stroke rehabilitation are not always consistent. In a recent review, seven controlled studies that evaluated the efficacy of music as an add-on therapy in stroke rehabilitation were identified (Sihvonen et al., 2017). In these studies, training of finger dexterity of the paretic hand was done using either a piano-keyboard, or, for wrist movements, drum-pads tuned to a C major scale. Superiority of the music group over fine motor training without music and over conventional physiotherapy was evident in one study after intervention comprising five 30-min sessions per week for 3 weeks (Schneider et al., 2010). The beneficial effect seen in the music group could be specifically attributed to the musical component of the training rather than the motor training per se, since patients practicing with mute instruments remained inferior to the music group. Here, the Fugl-Meyer Assessment (FMA) was applied before and after 20 sessions of either music supported therapy on a keyboard or equivalent therapy without sound. FMA scores of the motor functions of the upper limb improved by 16 in the music group and by 5 in the control group, both improvements being statistically significant although to a lesser degree in the control group (p = 0.02 vs. p = 0.04; Tong et al. (2015)).
En ce qui concerne les mécanismes neurophysiologiques de la thérapie musicale neurologique, il a été démontré que les patients bénéficiant d'une thérapie soutenue par la musique non seulement recouvraient leurs capacités motrices plus rapidement, mais amélioraient également le timing, la précision et la fluidité des habiletés motrices fines, tout en montrant des augmentations de la connectivité neuronale entre les cortices sensorimoteurs et auditifs, évaluées au moyen de la cohérence EEG-EEG (Altenmüller et al., 2009; Schneider et al., 2010).
Ces conclusions sont corroborées par une étude de cas d'un patient ayant suivi un entraînement soutenu par la musique 20 mois après avoir subi un AVC. En plus de l'amélioration clinique, l'imagerie par résonance magnétique fonctionnelle (IRMf) a montré une activation des zones motrices et prémotrices lors de l'écoute de simples mélodies de piano, fournissant ainsi des preuves supplémentaires de l'établissement d'une co-représentation auditive-sensorimotrice due à la procédure d'entraînement (Rojo et al., 2011). De même, dans un groupe plus large de 20 patients victimes d'AVC chroniques, des augmentations de l'excitabilité du cortex moteur après 4 semaines de thérapie musicale soutenue ont été démontrées à l'aide de la stimulation magnétique transcrânienne (TMS), accompagnées de nettes améliorations des habiletés motrices fines (Amengual et al., 2013).
En plus de la réorganisation fonctionnelle du réseau auditif-sensorimoteur, des découvertes récentes ont rapporté des changements dans la cognition et l'émotion après une thérapie musicale soutenue chez des patients victimes d'AVC chroniques. Dans un essai contrôlé randomisé (ECR) d'une durée de 10 semaines, incluant 14 patients avec une thérapie musicale soutenue et 14 patients recevant une physiothérapie conventionnelle, Fujioka et al. (2018) ont démontré que les deux groupes montraient uniquement de légères améliorations. Cependant, le groupe musical s'est significativement mieux comporté dans le test de tracé de chiffres, indiquant une amélioration de la flexibilité cognitive, et a en outre montré une participation sociale et communautaire accrue dans l'échelle d'impairment post-AVC et dans le PANAS (Positive and Negative Affect Schedule, Watson et al., 1988), apportant ainsi un soutien aux effets prosociaux et motivationnels de la musique. Dans un autre ECR avec une intervention de seulement 4 semaines, Grau-Sánchez et al. (2018) n'ont pas démontré de supériorité dans les habiletés motrices fines dans le groupe musical par rapport à un groupe témoin, mais plutôt une augmentation de la qualité de vie générale telle qu'évaluée par le Profile of Mood States et le questionnaire spécifique à la qualité de vie après un AVC. Malgré les preuves croissantes, les mécanismes neurophysiologiques de la thérapie musicale neurologique restent mal compris.
La plupart des études existantes sur la thérapie soutenue par la musique se sont concentrées sur la rééducation des fonctions motrices fines de la main. Beaucoup moins de preuves existent sur la rééducation post-AVC des fonctions motrices globales des membres supérieurs. Dans une étude précédente, nous avons donc développé une thérapie de sonification des mouvements afin d'entraîner les fonctions du bras supérieur et de l'épaule (Scholz et al., 2015). Les mouvements brusques du bras étaient transformés en sons discrets, fournissant une rétroaction continue de manière mélodique, accordée à une échelle majeure (c'est-à-dire que les patients pouvaient utiliser les mouvements de leurs bras parétiques comme un instrument de musique). De cette manière, la perception sonore se substituait à la proprioception défectueuse. Dans une première étude pilote chez des patients victimes d'AVC subaiguës, nous avons pu démontrer que la thérapie de sonification musicale réduisait la douleur articulaire dans la sous-échelle de douleur de Fugl-Meyer (différence entre les groupes : -10 ; d = 1,96) et améliorait la fluidité des mouvements (d = 1,16) par rapport à la thérapie de mouvement sans son (Scholz et al., 2016). Ici, nous étendons ces résultats en comparant les effets du dispositif de sonification musicale établi (Scholz et al., 2016) avec un dispositif de sonification nouvellement développé et moins coûteux dans un groupe de patients victimes d'AVC subaiguës avec des déficiences motrices des membres supérieurs. Les seules différences apparentes entre les deux méthodes d'acquisition de données étaient la qualité sonore améliorée et la perte de la nécessité de fixer des capteurs aux membres des patients. Afin d'élucider davantage les fondements neurophysiologiques de la thérapie de sonification musicale, nous avons enregistré simultanément des données EEG et EMG chez un sous-ensemble de patients pour analyser la cohérence de phase cortico-musculaire lors des mouvements des membres supérieurs (Chen et al., 2018; Pan et al., 2018). Selon des études précédentes (Pan et al., 2018), nous avons émis l'hypothèse que la cohérence de phase cortico-musculaire augmentait dans l'hémisphère ipsilésionnel après la thérapie de sonification musicale.
Matériaux et méthodes
Patients
Les critères d'inclusion des patients étaient un AVC unilatéral aigu ou subaigu sur un hémisphère, déterminé par le médecin admis en fonction du tableau clinique des patients. Aucun autre outil de dépistage ou seuil n'a été utilisé. Les critères d'exclusion étaient les rapports d'aphasie, de déficits neurologiques, psychiatriques ou cognitifs supplémentaires. De plus, les patients devaient être capables d'effectuer des mouvements bruts du bras sans l'assistance du membre du côté non affecté.
Pour le Site 1, un patient a été inscrit au ZAR Tübingen, Allemagne (centre de rééducation ambulatoire), et 11 patients ont été inscrits aux cliniques M&I Hohenurach, Bad Urach, Allemagne. À la Clinique BDH Hessisch-Oldendorf, Allemagne, désormais appelée Site 2, 30 patients ont été inscrits. Deux patients du Site 2 ont été exclus en raison de la perte de données ou de la perte de suivi, respectivement.
Les patients ont été alternativement assignés soit au groupe témoin soit au groupe de traitement dans l'ordre d'inscription au Site 1, et assignés de manière pseudo-aléatoire au Site 2 au groupe expérimental ou au groupe témoin par le superviseur de l'étude qui n'était pas l'expérimentateur. Les deux groupes de traitement ont reçu une physiothérapie conventionnelle ainsi qu'un entraînement de sonification musicale. Les groupes témoins ont également reçu une physiothérapie conventionnelle et un entraînement supplémentaire de mouvements de sonification fictifs avec exactement les mêmes mouvements requis que dans le groupe de sonification, mais sans aucun son reproduit. Tous les patients étaient des locuteurs natifs allemands. Voir Tableau 1 et Figure 1 pour les caractéristiques des patients et les différences entre les groupes.
Table 1

Table 1. Patient characteristics.
Figure 1

Figure 1. Distributions postérieures des différences entre les groupes de traitement et de contrôle des variables testées, chacune avec une estimation ponctuelle médiane (point), un intervalle d'incertitude de 50 pour cent (barre horizontale épaisse en noir) et un intervalle d'incertitude de 90 pour cent (barre horizontale mince en noir). La partie d'une distribution donnée située à plus de 0,9 écart-type de zéro est montrée en bleu clair au lieu de gris. Les estimations ponctuelles >0 représentent des scores initiaux plus élevés dans le groupe de traitement, tandis que les valeurs <0 impliquent des scores initiaux plus élevés dans le groupe de contrôle. ARAT, Test d'action de recherche sur le bras ; BBT, Test de la boîte et des blocs ; BI, Indice de Barthel avant le début de la rééducation ; DSS, nombre de jours écoulés entre l'occurrence de l'AVC et le début de la rééducation ; FM.A-D, sous-échelles du test de Fugl-Meyer A-D, couvrant les réflexes, les mouvements volontaires, la fonction du poignet et de la main et la coordination du membre supérieur ; FM.H, sensation tactile dans l'extrémité affectée et non affectée ; FM.I, mouvement articulaire passif ; FM.J, douleur articulaire passive ; invNHPT, Test des neuf trous (inversé) ; SIS.1, problèmes physiques résultant de l'AVC ; SIS.2, capacités de mémoire et de réflexion ; SIS.3, humeur et émotions ; SIS.4, compétences de communication en parlant, lisant et écrivant ; SIS.5, altération des activités quotidiennes ; SIS.6, mobilité ; SIS.7, fonction restante de la main affectée ; SIS.8, altération des activités sociales ; SIS.9, auto-évaluation de la progression de la récupération après un AVC ; TLT, Test de localisation du pouce ; SIS.total, score total sur les sous-échelles de l'échelle d'impact de l'AVC. Voir la section "Matériaux et méthodes" pour plus de détails.
Cette étude a été menée conformément aux recommandations du Comité d'examen éthique de la Faculté de médecine de l'Université de Hanovre et du Comité d'éthique de la Faculté de médecine de l'Université Eberhard Karls de Tübingen. Le protocole a été approuvé par le Comité d'examen éthique de la Faculté de médecine de l'Université de Hanovre (numéro d'approbation 1767-2013) et le Comité d'éthique de la Faculté de médecine de l'Université Eberhard Karls de Tübingen (protocole numéro 597/2013BO2). Tous les sujets ont donné leur consentement éclairé par écrit conformément à la Déclaration d'Helsinki.
Configuration expérimentale
L'entraînement a eu lieu sous forme de séances individuelles régulières (voir jours d'entraînement dans le Tableau 1), au cours desquelles les patients étaient assis devant une table avec un cadre en bois sur le dessus. Le cadre était constitué d'une planche de 51 × 51 cm en bas qui était subdivisée en neuf champs numérotés également espacés (Figure 2A) pour simplifier les instructions sur l'endroit où dans le plan horizontal une tâche devait être réalisée. Des barres verticales (longueur : 51 cm) étaient attachées dans trois coins de la planche, toutes subdivisées par des marques clairement visibles en six intervalles également espacés. Chaque intervalle était étiqueté avec le nom de la hauteur d'une note de l'échelle de do majeur de do' (en bas) à la' (en haut). Les tâches devenaient de plus en plus complexes au cours de chaque séance et consistaient en des mouvements de haut en bas de la main à une position dans le plan x-z. Les instructions de mouvement de haut en bas pour chaque tâche étaient présentées séparément sous forme de séquence de hauteurs de notes de musique sur une feuille derrière le cadre. Les tâches consistaient en quatre échelles ascendantes et descendantes en do majeur, limitées aux six premières notes (c'est-à-dire do'-ré'-mi'-fa'-sol'-la' et sol'-fa'-mi'-ré'-do') à chacune des positions 1, 2, 7 et 9 (Figure 2A) ainsi que des intervalles musicaux de do' à ré', de do' à mi', de do' à fa', de do' à sol' et de do' à la'. Cet exercice a également été répété quatre fois aux positions 1, 2, 3, 7 et 9. Le but final de l'entraînement était d'apprendre aux patients à jouer plusieurs comptines simples ou d'autres airs familiers uniquement en déplaçant leur bras affecté dans l'espace de sonification tridimensionnel. Les patients ont toujours déplacé leurs bras atteints par eux-mêmes sans l'aide ni de leur bras non affecté ni de l'expérimentateur.
Figure 2

Figure 2. Configuration expérimentale. (A) Espace tridimensionnel (le contrôleur Leapmotion au Site 2 était placé sur la planche à la position marquée en violet), avec des étiquettes d'axe décrivant des changements sonores qualitatifs lorsque la main était déplacée par rapport au cadre (et donc, au corps). (B) Capteurs Xsens tels qu'utilisés au Site 1, attachés au poignet et au bras supérieur du patient. (C) Contrôleur Leapmotion tel qu'utilisé au Site 2, avec les axes de l'espace superposés. Le panneau (A) est tiré de Scholz et al. (2016).
Les patients au Site 1 portaient des capteurs inertie Xsens (modèle X-MB-XB3 ; Figure 2B)1 au poignet et au bras supérieur qui transmettaient les données d'accélération, de rotation et de gravité via Bluetooth® à un ordinateur avec un logiciel sur mesure qui déduisait les coordonnées actuelles de la main par rapport aux dimensions du cadre en bois et cartographiait ainsi la position ainsi déterminée à un son prédéfini.
Au Site 2, un contrôleur Leapmotion (Figure 2C)2 était situé au bord avant de la planche. Le contrôleur se compose de trois émetteurs de lumière infrarouge et de deux caméras infrarouges et suit les mouvements de la main en trois dimensions. Le contrôleur transférait les coordonnées du centroïde de la paume du patient dans l'espace prédéfini à un programme informatique sur mesure sur un ordinateur. Là, les coordonnées étaient cartographiées aux paramètres sonores correspondants qui étaient ensuite restitués au patient en temps réel.
Les hauteurs de notes variaient de do' = 226,6 Hz en bas à la à = 440 Hz en haut. Sur l'axe x, le son variait en luminosité via une variation dans la synthèse sonore (Site 1 ; Synthesis ToolKit, Cook et Scavone, 1999) ou des échantillons sonores utilisés (Site 2) avec trois timbres différents (du terne = son de clarinette sur le côté gauche du patient, au saxophone au milieu, et un instrument à archet = brillant à droite). Le volume des sons était cartographié le long de l'axe z, de sorte qu'une position de main proximale produisait un son plus fort qu'une position plus distale. Les séances d'entraînement régulières duraient environ 30 minutes.
Évaluation des fonctions motrices et de l'impact de l'accident vasculaire cérébral
L'évaluation du processus de rééducation des patients a été réalisée en administrant plusieurs tests cliniques de fonction motrice et un questionnaire psychologique avant et après l'entraînement.
Les tests cliniques de la fonction motrice se composaient de six sections principales :
- (a) La partie des membres supérieurs du FMA, toujours considérée comme la référence pour l'évaluation de la récupération motrice après un AVC (Crow and Harmeling-van der Wel, 2008; Woodbury et al., 2008). Le FMA comprend quatre sous-sections principales
- • FM.A-D : réflexes, mouvements volontaires, fonction du poignet et de la main et coordination du membre supérieur
- • FM.H : sensation tactile dans l'extrémité affectée et non affectée
- • Dans FM.I : mouvement articulaire passif
- • FM.J : douleur articulaire passive en mouvement
- (b) Le test de la boîte et des blocs (BBT) évalue la dextérité manuelle brute unilatérale (Mathiowetz et al., 1985; Canny et al., 2009; Chen et al., 2009)
- (c) Le test des neuf trous mesure la dextérité des doigts (Grice et al., 2003). À des fins de modélisation et pour simplifier la présentation des données, les scores obtenus ont été inversés (invNHPT)
- (d) L'échelle d'impact de l'AVC (SIS ; Duncan et al., 2003; Lin et al., 2010) évalue l'état de santé après un AVC, comprenant des sous-échelles pour le bien-être émotionnel, la mémoire, la pensée et la participation sociale. Les sous-échelles numérotées consécutivement sont
- (1) problèmes physiques dus à l'AVC
- (2) capacités de mémoire et de pensée
- (3) humeur et émotions
- (4) compétences de communication en parole, lecture et écriture
- (5) altération des activités quotidiennes
- (6) mobilité
- (7) fonction restante de la main affectée
- (8) altération des activités sociales
- (9) auto-évaluation de la progression de la récupération après un AVC
- (e) Test de localisation du pouce (TLT ; Hirayama et al., 1999)
- (f) Le test d'action de recherche sur le bras (ARAT ; Lyle, 1981)
De plus, l'Indice de Barthel (BI ; Mahoney and Barthel, 1965) avant l'intervention, et le nombre de jours entre la survenue de l'accident vasculaire cérébral et le début de l'intervention (Jours Depuis l'AVC - DSS) ont été recueillis. L'administration de la batterie de tests d'évaluation motrice et du questionnaire avant et après l'intervention a pris environ 1 heure pour être complétée.
Enregistrements EMG et EEG
À Site 1, des données électrophysiologiques ont été acquises auprès de deux sujets ayant suivi une thérapie musicale (les deux avec un AVC hémisphérique gauche, formés sur le bras droit) et deux sujets ayant suivi une thérapie de contrôle (un avec un AVC hémisphérique gauche, formé sur le bras droit ; un avec un AVC hémisphérique droit, formé sur le bras gauche), avant et après la thérapie. Les sujets ont été instruits pour effectuer cent élévations auto-dirigées de leur bras parétique et non-parétique, respectivement, en blocs séparés d'essais, et à une fréquence d'environ une élévation toutes les 5 secondes. Plus précisément, les sujets ont été invités à élever leur bras de c’ à d’ dans l'axe y à la position 1 (bras droit) et à la position 3 (bras gauche), respectivement, dans l'espace d'entraînement tridimensionnel (cf. Figures 1A,B), en plus de l'entraînement des mouvements de l'échelle de do majeur vers le haut pendant la thérapie. L'EMG (des muscles deltoïdes) et l'EEG à 20 canaux ont été enregistrés à l'aide d'un système EEG-9200 Neurofax (Nihon Kohden, Japon). La position des électrodes EEG suivait le système international 10-20 (Seeck et al., 2017), et les données EEG étaient référencées à A1 et A2 (lobes d'oreille liés). Les biosignaux ont été enregistrés à une fréquence d'échantillonnage de 200 Hz. Les impédances des électrodes étaient régulièrement vérifiées et maintenues en dessous de 10 kΩ tout au long de l'expérience.
Fluidité du mouvement
Les trajectoires de mouvement de la première tâche des patients (quatre échelles de do majeur à la position 1) de chaque jour d'entraînement ont été identifiées manuellement et séparées en coups vers le haut et vers le bas pour le calcul hors ligne de la fluidité du mouvement. Conformément à Osu et al. (2011), dans chacun de ces coups, la courbure tridimensionnelle κ2 pour chaque point temporel a été déterminée :
La médiane du logarithme naturel négatif du vecteur κ2 de chaque mouvement a été prise comme mesure de sa fluidité de mouvement.
Analyse des données
Les données EEG et EMG ont été analysées à l'aide de MATLAB (version R2017b, The MathWorks) avec les boîtes à outils EEGLAB (version 13.5.4b; Delorme et Makeig, 2004) et Fieldtrip (Oostenveld et al., 2011). Le langage de programmation R (version 3.5.1; R Core Team, 2018) en conjonction avec RStudio Server (version 1.2.1080; RStudio Team, 2018) a été utilisé pour tout autre prétraitement et analyse des données.
Pour tenir compte des petits échantillons, des tailles de groupe déséquilibrées et d'un nombre décroissant de points de données au fil du temps (voir la section "Résultats" sur la perte de données), nous avons opté pour la modélisation de régression multiniveaux bayésienne pour analyser les résultats des tests moteurs et les données de fluidité des mouvements. La modélisation a été réalisée avec le package R brms (Bürkner, 2018). En régression bayésienne, les petits échantillons peuvent être maîtrisés en utilisant des a priori informatifs, tandis que l'incertitude croissante concernant la distribution des paramètres estimés en raison du nombre décroissant de points de données au fil du temps, par exemple, causée par la perte de données ou l'abandon, se reflète par des intervalles de crédibilité de plus en plus larges, reconnaissant l'incertitude croissante. La modélisation multiniveaux (MLM) aide également à maintenir la cohérence des petits groupes par un regroupement partiel, ce qui conduit essentiellement à une réduction des estimations de niveau inférieur vers les estimations de niveau supérieur. Par exemple, si le niveau le plus élevé d'un MLM est le regroupement en traitement et en témoins, alors les moyennes de groupe peuvent être estimées en fonction de la grande moyenne. Une estimation de groupe lointaine est ensuite réduite vers la grande moyenne, et d'autant plus, moins cette estimation extrême contient de points de données (Gelman et al., 2012).
Batteries de tests moteurs et l'échelle d'impact de l'accident vasculaire cérébral
Des régressions bayésiennes simples ont été effectuées pour toutes les sous-échelles de la batterie de tests moteurs avant l'intervention, avec le prédicteur Traitement (0|1), afin de déterminer les différences entre les deux groupes avant l'intervention. Les scores pré-intervention des variables de résultat ont été transformés en z pour augmenter la stabilité computationnelle, et les a priori ont été choisis comme informatifs avec des queues lourdes pour permettre des valeurs extrêmes (distribution de Student centrale t : df = 3; scale = 1; borné à gauche à zéro pour les paramètres de variance).
Les distributions postérieures des différences pré-intervention entre les groupes de traitement et de contrôle dans les batteries de tests moteurs, les scores SIS et le nombre de jours entre l'accident vasculaire cérébral et le début de l'intervention sont montrées dans la Figure 1. Presque toutes les distributions de différences se chevauchent considérablement avec zéro, à l'exception notable de SIS.1, qui était plus grande dans le groupe de traitement, tandis que SIS.8 était plus grande dans le groupe témoin.
Fluidité du mouvement
Des modèles multiniveaux de plus en plus complexes ont été construits en utilisant les ensembles de données conjoints des deux sites afin d'examiner et de mieux comprendre les processus de génération de données sous-jacents. Tous les modèles incluaient la fluidité des mouvements transformée en z (moyenne nulle et écart type unitaire) en tant que résultat. Le modèle le plus simple utilisait le groupe de patients comme prédicteur au niveau de la population, tandis que les modèles ultérieurs incluaient un nombre croissant de variables explicatives, modélisant éventuellement des coefficients variables corrélés (voir Table 2). Toutes les priors ont été choisies pour être informatives ; les pentes étaient modélisées pour être distribuées selon une loi de Student avec df = 3, centrées sur zéro, et avec une échelle fixée à 3, et bornées à gauche à zéro pour les composantes de variance ; les priors placés sur les matrices de corrélation de paramètres variables étaient des LKJcorr, avec η = 2. La précision de prédiction entre les modèles a été comparée en utilisant une validation croisée de type leave-one-out avec échantillonnage d'importance lissé de Pareto (Vehtari et al., 2017), une approximation à la validation croisée leave-one-out.
Table 2

Table 2. Parameter estimates of models used to explain movement smoothness over time in treatment and control groups, using two different motion capturing systems.
EMG et EEG
Les marqueurs d'événements EMG pour le début du mouvement ont été réglés manuellement par inspection visuelle et en utilisant un seuil individuellement ajusté de 30 à 110 μV selon les niveaux de bruit individuels. Les données EMG post-thérapie d'un sujet qui a suivi une thérapie de contrôle étaient trop bruyantes pour permettre une identification fiable des débuts de mouvement ; ce sujet a été exclu de l'analyse ultérieure. Les données des trois autres sujets (deux patients ayant subi un AVC hémisphérique gauche avec une thérapie musicale, un patient ayant subi un AVC hémisphérique droit avec une thérapie de contrôle) ont été analysées à l'aide de MATLAB (R2017b, MathWorks) et de la boîte à outils open-source Fieldtrip (Oostenveld et al., 2011), avec des scripts personnalisés. Les essais ont été inspectés visuellement et les essais bruyants ont été exclus de l'analyse ultérieure. Pour les patients ayant suivi une thérapie musicale, 96 époques avant (pré) et 98 époques après (post) la thérapie, et 98 époques pour les mesures pré et post-thérapie, respectivement, ont été considérées ; pour le patient avec une thérapie de contrôle, 85 essais pour les mesures pré et post-thérapie ont été considérés. Les données ont d'abord été détrendues et filtrées en bande passante entre 2 et 80 Hz. Ensuite, les données ont été filtrées avec un filtre passe-bande Butterworth d'ordre 3 de 1 à 80 Hz et un filtre éliminant la bande de fréquence de 49 à 51 Hz. Comme mesure de la cohérence de phase cortico-musculaire, l'indice de déphasage pondéré (WPLI) a été calculé entre les canaux EEG et EMG, suivant des rapports antérieurs (Stam et al., 2007; Vinck et al., 2011). Comme les cohérences de phase étaient significatives (Rosenberg et al., 1989) dans les canaux de la zone sensorimotrice (c'est-à-dire, les électrodes C3 et C4, respectivement) pré et post-thérapie avec une probabilité de confiance de 95 % uniquement dans la bande de fréquence du bas bêta (14-20 Hz), les analyses ultérieures ont été restreintes à la bande de bas bêta.
Une analyse de permutation en cluster (Maris et al., 2007) a été réalisée pour tester les différences significatives de cohérence de phase cortico-musculaire dans la bande bêta avant et après la thérapie. Les statistiques en cluster ont été évaluées au niveau du sujet individuel, en considérant chaque essai comme une unité d'observation. Le nombre minimum de canaux voisins pour former un cluster était de 2. Un cluster positif a été défini comme WPLI Post > WPLI Pre, un cluster négatif comme WPLI Post < WPLI Pre. Le niveau de signification a été fixé à p < 0.05.
Résultats
Batteries de tests moteurs et échelle d'impact de l'accident vasculaire cérébral
Les différences post-traitement dans les batteries de tests moteurs et le SIS sont représentées dans Figure 3, tandis que le Tableau S1 supplémentaire liste les estimations ponctuelles postérieures ainsi que les intervalles de crédibilité, séparément pour les deux sites. Toutes les estimations ponctuelles de différence étaient proches de zéro, et la plupart avaient des intervalles de crédibilité très larges, ce qui indique une grande hétérogénéité des données qui a entravé une estimation plus précise étant donné l'échantillon.
Figure 3
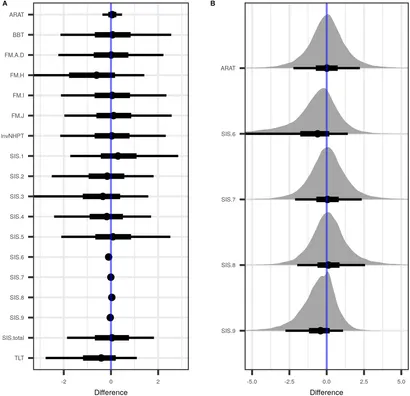
Figure 3. Différences estimées entre le groupe de traitement et le groupe témoin, lorsque les données des deux sites ont été combinées et que les valeurs prétraitement ont été prises en compte. (A) Sont présentées les distributions a posteriori des différences entre les groupes de traitement et de contrôle des variables testées, avec estimation ponctuelle médiane (point), intervalle d'incertitude à 50 % (barre horizontale noire épaisse) et intervalle d'incertitude à 90 % (barre horizontale noire mince). (B) Un zoom sur les variables de A avec une estimation ponctuelle proche de zéro. ARAT, Test de l'action de recherche sur le bras; BBT, Test de la boîte et des blocs; FM.A-D, Sous-échelles du test de Fugl-Meyer A–D, couvrant les réflexes, les mouvements volontaires, la fonction du poignet et de la main et la coordination du membre supérieur; FM.H, Sensation tactile dans l'extrémité affectée et non affectée; FM.I, Mouvement passif des articulations; FM.J, Douleur articulaire passive; invNHPT, Test des neuf trous (inversé); SIS.1 (Échelle d'impact de l'AVC, sous-échelle 1), problèmes physiques résultant de l'AVC; SIS.2, Mémoire et capacités de réflexion; SIS.3, Humeur et émotions; SIS.4, Compétences en communication (parler, lire et écrire); SIS.5, Altération des activités quotidiennes; SIS.6, Mobilité; SIS.7, Fonction restante de la main affectée; SIS.8, Altération des activités sociales; SIS.9, Auto-évaluation de l'avancement de la récupération après un AVC; TLT, Test de localisation du pouce; SIS.total, score total de l'échelle d'impact de l'AVC. Voir la section "Matériaux et méthodes" pour plus de détails.
Fluidité du mouvement
Les modèles d'évaluation de la fluidité n'ont pas convergé pour les données du Site 1 seul, probablement en raison d'une combinaison d'hétérogénéité prononcée et de petite taille d'échantillon. Une quantité importante de données sur la fluidité au site 2 a été perdue en raison d'une combinaison d'erreurs humaines et techniques. Alors que les patients ont suivi le calendrier d'entraînement régulier avec une médiane de 22 (groupe de traitement) et 16,5 (groupe témoin) sessions d'entraînement (voir aussi jours d'entraînement dans Tableau 1), les données disponibles pour l'analyse n'avaient qu'une médiane (plage) de 2,5 (1,7) sessions. Nous avons donc décidé de regrouper les données de mouvement des deux sites.
Dans l'ensemble de données combinées sur la fluidité, le modèle le plus simple a estimé une augmentation substantielle de la fluidité moyenne pour les deux groupes [environ 0,5 (IC : 0, 0,9) écarts-types], mais avec un intervalle crédible large (modèle n°1 dans Figure 4 et Tableau 2). L'ajout ultérieur de Session, et de l'interaction Groupe:Session (modèle n°2) en tant qu'entrée de régression, ainsi que la modélisation de la corrélation entre les intercepteurs individuels et leurs pentes de session (modèle n°3) n'ont pas considérablement modifié l'estimation de l'effet moyen du groupe. L'effet de la Session et l'interaction Groupe:Session ont été estimés proches de zéro, avec des intervalles de crédibilité à 90% largement chevauchants avec zéro, ce qui indique des changements de fluidité non pertinents entre les sessions. Cependant, l'ajout de la fluidité prétraitement en tant que covariable (modèle n°4) a entraîné une diminution décente de l'estimation de l'effet moyen du groupe. L'ajout du type de dispositif de capture de mouvement utilisé sur un site donné (MoCap, #5) n'a pas modifié davantage l'estimation du groupe, ni n'a conduit à une augmentation de la précision prédictive (Tableau S2 supplémentaire). Néanmoins, l'effet du MoCap n'était pas négligeable. Ce dernier résultat nous a conduits à modéliser a posteriori l'interaction Groupe:MoCap (#6), qui a été estimée très proche de zéro. L'effet inattendu du MoCap a conduit à une exploration supplémentaire de l'interaction Pré fluidité:MoCap, qui a été estimée proche de zéro (#7).
Figure 4

Figure 4. Comparaison des paramètres de population tels qu'estimés par des modèles de complexité croissante, en commençant par le plus simple (#1), qui modélisait le résultat comme le résultat du Groupe, et donc n'avait que deux paramètres (Intercept et Groupe ; voir Tableau 2 pour une représentation numérique des données). Le modèle 2 employait en outre le facteur temporel (Session) en tant que variable explicative, et son interaction avec le Groupe, et a donc deux estimations de paramètres supplémentaires, et ainsi de suite. Les trois premiers modèles ne changent pas considérablement, seul l'ajout de la fluidité du mouvement pré-interventionnel en tant que covariable dans le modèle 4 rapproche l'estimation du Groupe de zéro. Dans le modèle 5, avec le système de capture de mouvement ajouté en tant que covariable (MoCap), l'estimation du Groupe ne change pas beaucoup bien que l'effet de MoCap soit perceptible.
Alors que dans la régression non bayésienne, le R2 ajusté sert de mesure contre le surajustement, les probabilités a priori dans les modèles bayésiens et le rétrécissement dans le MLM servent conjointement au même but, ainsi que la validation croisée leave-one-out estimée de la log-vraisemblance postérieure (PSIS-LOO-CV; Vehtari et al., 2017). Cette dernière est également utilisée pour trouver le meilleur modèle en identifiant les différences de densité prédictive log attendues (elpd) entre les modèles. Voir Tableau S2 supplémentaire. La Figure 5 montre des graphiques conditionnels des effets au niveau de la population pour le modèle #5, plaçant les estimations des paramètres de la Figure 4 dans le contexte des données.
Figure 5
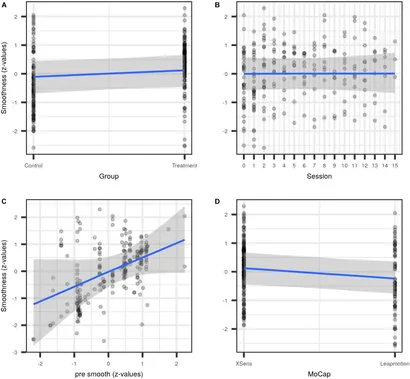
Figure 5. Graphiques conditionnels pour le modèle #5. Effets de population pour les covariables Groupe (A), session médianisée (B), lissage pré-intervention standardisé pré lissage (C), et le système de capture de mouvement MoCap (D).
Le modèle le mieux ajusté (#5) a estimé une augmentation moyenne du lissage des mouvements pour le Groupe de 0,21 [−0,09, 0,52]; voir Tableau 2.
Coherence de phase cortico-musculaire
Les analyses exploratoires de la cohérence de phase EEG-EMG dans la bande bêta, mesurée avec WPLI pendant le mouvement du bras parétique, ont montré un cluster EEG positif dans l'hémisphère gauche (lésionné) (canaux : Fp1, Fp2, F3, C3, P3, F7, T3, T5) pour le patient 1 avec une thérapie musicale, et un cluster positif dans l'hémisphère gauche (lésionné) (canaux : F7, T3, T5, P3, O1, Pz) et un cluster négatif postérieur droit (canaux : O2, T6, T4) pour le patient 2 avec une thérapie musicale (Figure 6). Ces résultats indiquent une augmentation de la cohérence de phase cortico-musculaire post-thérapie musicale par sonification par rapport à la pré-thérapie dans l'hémisphère ipsilésionnel lors du mouvement du bras parétique. En revanche, pour le patient avec une thérapie de contrôle, qui avait subi un AVC hémisphérique droit, un cluster frontal positif (canaux : Fp1, Fp2, F3, Fz, F4, F8) et un cluster postérieur négatif (canaux : Pz, P4, T6, O1, O2) avec une topographie bilatérale ont été trouvés dans les comparaisons post-thérapie par rapport à pré-thérapie. À noter que pour les mouvements avec le bras non parétique, aucun cluster significatif n'a été trouvé chez aucun patient (données non montrées), ce qui indique des cohérences de phase cortico-musculaires similaires (c'est-à-dire des valeurs WPLI) aux deux moments de mesure pendant le mouvement du bras non entraîné chez tous les patients.
Figure 6

Figure 6. Modulation de la cohérence de phase cortico-musculaire pendant le mouvement du bras parétique (données de sujets individuels). Les topoplots de WPLI comme mesure de la cohérence de phase cortico-musculaire avant (pré) et après (post) la thérapie chez deux patients avec thérapie musicale (Pat 1 et Pat 2, tous deux AVC hémisphérique gauche, bras droit entraîné, deux premières lignes) et un patient avec thérapie de contrôle (AVC hémisphérique droit, bras gauche entraîné, dernière ligne) sont montrés dans la colonne de gauche et du milieu, respectivement. Les cartes de t-statistique (stat) des analyses basées sur les clusters des différences de WPLI post vs pré thérapie sont montrées dans la colonne de droite. Les canaux appartenant à des clusters significatifs sont marqués d'astérisques. Notez l'augmentation de la cohérence de phase cortico-musculaire hémisphérique gauche (c'est-à-dire ipsilésionnel) lors des mouvements du bras parétique droit chez les deux patients avec thérapie musicale, tandis que le patient avec thérapie de contrôle a montré une topographie plutôt bilatérale des modulations de cohérence de phase cortico-musculaire lors des mouvements du bras parétique gauche.
Discussion
En résumant les effets de la rééducation du membre supérieur après un AVC, il n'est pas clair si l'entraînement à la sonification musicale est efficace. La régression bayésienne de plusieurs batteries de tests moteurs et de l'échelle d'impairment de l'AVC n'a pas fourni de preuves étayant un effet supplémentaire du traitement. Cependant, le MLM a révélé que la fluidité des mouvements du groupe de traitement était plus grande, bien que l'intervalle crédible chevauchait zéro (Figures 4, 5). Cela suggère un petit effet, le cas échéant, de l'entraînement à la sonification musicale sur la fluidité des mouvements. L'ajout de la fluidité prétraitement en tant que covariable au modèle (modèle 4) a considérablement diminué l'estimation de l'effet du Groupe. Cela suggère que l'hétérogénéité de la fluidité des mouvements prétraitement dans l'échantillon a considérablement influencé la précision avec laquelle l'amélioration pouvait être estimée. Lorsque le type de système de capture de mouvement a été ajouté au modèle en tant que prédicteur (modèle 5), il a capturé une quantité substantielle de variation. Ce dernier point peut s'expliquer de plusieurs manières, non exclusives. Il est possible que les échantillons des deux sites diffèrent plus que prévu, et cette différence n'était pas apparente lors du dépistage prétraitement (Figure 2). Ou, la manipulation différenciée des patients sur les deux sites a peut-être conduit à des succès différents de la rééducation supplémentaire. Une troisième explication possible, corroborée par nos données, serait la résolution temporo-spatiale différente des deux systèmes de capture de mouvement (Figure 5D), ce qui fait que le capteur Leapmotion trouve des mouvements de groupes comparables "plus grossiers" que ne le ferait le système Xsens.
Les analyses exploratoires de la cohérence EEG-EMG pendant le mouvement du bras parétique chez un sous-ensemble de nos patients ont suggéré une augmentation de la cohérence de phase cortico-musculaire dans la bande bêta spécifiquement dans l'hémisphère léésionné après la thérapie de sonification musicale, mais pas après l'entraînement moteur sans sonification (cf. Figure 6). À noter que la cohérence de phase cortico-musculaire pendant le mouvement du bras non-paretique n'a pas changé après l'un ou l'autre des entraînements. Ces résultats sont cohérents avec des résultats précédents montrant une augmentation de la cohérence de phase cortico-musculaire dans la bande bêta dans l'hémisphère léésionné après 4 semaines de stimulation électrique du nerf médian combinée à un entraînement de la fonction de la main, mais pas après un entraînement de la fonction de la main seul (Pan et al., 2018). Que les augmentations de la cohérence de phase cortico-musculaire dans la bande bêta sous-tendent effectivement les améliorations cliniques de la fonction motrice du membre supérieur après la thérapie de sonification musicale, et comment ces changements sont liés à la réorganisation fonctionnelle du réseau auditivo-sensorimoteur (Altenmüller et al., 2009; Schneider et al., 2010; Fujioka et al., 2012) ou d'autres (par exemple, les réseaux cérébraux fronto-pariétaux) doivent être étudiés dans des études futures.
Divers autres mécanismes ont été impliqués dans les effets de la thérapie musicale sur la fonction motrice après un AVC. À partir des descriptions informelles des patients de leur expérience avec l'entraînement musical, il semble que cela a été très agréable et un moment fort de leur processus de rééducation, quel que soit le type de stimulation auditive. Ainsi, comme cela a déjà été exploré dans des articles antérieurs, des facteurs motivationnels et émotionnels pourraient avoir contribué à l'amélioration du programme d'entraînement (comme rapporté dans Särkämö et al., 2008). De plus, le rôle de la rétroaction auditive dans la thérapie musicale nécessite une enquête plus approfondie. Jusqu'à présent, il n'a pas été clarifié si la rétroaction auditive en soi (par exemple, des sons de bip simples) peut avoir un effet similaire sur la rééducation fine de la motricité post-AVC, ou si des paramètres musicaux explicites tels qu'une structure de hauteur et de tempo sophistiquée sont des prérequis pour le succès de l'entraînement. Cela doit être abordé dans une étude comparant les effets de la rétroaction musicale à ceux de la rétroaction acoustique simple. En ce qui concerne cette dernière, selon une étude de Thaut et al. (2002), un balisage rythmique simple avec un métronome améliore significativement la précision spatio-temporelle des mouvements de préhension chez les patients victimes d'un AVC.
Enfin, il n'est pas clair si la régularité et la prévisibilité du timing sont cruciales pour l'effet bénéfique de la thérapie musicale. Bien qu'il ait été soutenu que l'efficacité de cette thérapie repose sur le fait que le cerveau du patient reçoit une rétroaction auditive verrouillée dans le temps à chaque mouvement, de nouveaux résultats remettent en question ce point de vue. Dans une étude récente, 15 patients en rééducation précoce après un AVC et sans expérience musicale préalable ont été étudiés (van Vugt et al., 2016). Ils ont appris à jouer des exercices simples de doigts et des chansons d'enfants familières au piano. Les participants ont été répartis dans l'un des deux groupes : dans le groupe normal, le clavier émettait un son immédiatement au moment de la frappe des touches, dans le groupe de retard, le son était retardé de manière aléatoire. Pour évaluer la récupération, des tests cliniques standard tels que le test des neuf chevilles et la vitesse et la régularité de tapotement du doigt indicateur ont été utilisés. De manière surprenante, les patients du groupe de retard se sont améliorés dans le test des neuf chevilles, tandis que ceux du groupe normal ne l'ont pas fait. Le groupe normal a montré une réduction de la dépression tandis que le groupe de retard ne l'a pas fait. Ainsi, la thérapie musicale, même avec un clavier à retardement aléatoire, peut améliorer la récupération motrice après un AVC, peut-être parce que les patients du groupe de rétroaction retardée apprennent implicitement à être indépendants de la rétroaction auditive et donc surpassent ceux de la condition normale lorsque la rétroaction auditive n'est pas disponible.
En résumé, la thérapie de sonification musicale pour la rééducation des déficiences motrices des membres supérieurs est une option de traitement viable, mais avec des effets cliniques limités chez les patients atteints d'AVC subaigu. Étant donné l'enthousiasme des patients pendant l'entraînement et le faible coût matériel pour l'un des dispositifs de sonification, il peut être envisagé comme une thérapie de neurorééducation à domicile supplémentaire. Les recherches futures devraient aborder la durabilité à long terme des améliorations et s'efforcer d'optimiser la durée et le nombre de séances d'entraînement, selon les besoins et les préférences des patients. Très probablement, un algorithme de traitement adapté au client, tenant compte de la gravité de l'impairment, de l'état psychologique et de la motivation du patient, serait le plus efficace.
Déclaration de disponibilité des données
Tous les ensembles de données générés pour cette étude sont inclus dans l'article/Matériel supplémentaire.
Déclaration d'éthique
L'étude a été approuvée par le Comité d'éthique de l'École de médecine de Hannover (numéro d'approbation 1767-2013) et le Comité d'éthique de la Faculté de médecine de l'Université Eberhard Karls de Tübingen (protocole numéro 597/2013BO2).
Contributions des auteurs
NN et DS partagent la première auteure de cette publication. MG et SS ont effectué la collecte et l'analyse des données pour le Site 2 (Hessisch Oldendorf). JS, PB et FM-D ont effectué la collecte et l'analyse des données pour le Site 1 (Tübingen). JDR a coordonné et contribué à la nouvelle conception audio sur le Site 2. UZ est l'auteur principal et PI pour le Site 1. JR et EA sont les auteurs principaux et PIs pour le Site 2.
Conflit d'intérêts
Les auteurs déclarent que la recherche a été menée en l'absence de tout lien commercial ou financier pouvant être interprété comme un conflit d'intérêts potentiel.
Le relecteur TS a déclaré une ancienne co-auteure avec l'un des auteurs EA à l'éditeur en charge du traitement.
Remerciements
Nous sommes redevables aux personnes suivantes pour leur travail : Messieurs S. Rummel et T. Engert à l'Université des Arts Populaires de Berlin, en Allemagne, ont programmé le programme d'acquisition de données et de sonification pour le capteur Leapmotion. Monsieur B. Krüger (Département des Systèmes Microélectroniques, Université de Hanovre, Allemagne) a écrit le logiciel pour le système de capteurs Xsens. Le professeur H. Ackermann et l'équipe de thérapeutes occupationnels des cliniques M&I Hohenurach, Bad Urach, en Allemagne, ont permis et soutenu l'étude sur le Site 1.
Matériel supplémentaire
The Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fnins.2019.01378/full#supplementary-material